Temperatura y Calor
Durante las vacaciones de verano, Pedro y su hermana Lupita fueron con su familia a un balneario. Observaron que el piso de concreto del balneario durante el día estaba más caliente que por la noche, mientras que con el agua de la alberca ocurría lo contrario, en el día estaba más fría que por la noche, ¿por qué ocurría esto? También, se cuestionaron si en el día ¿el concreto se encontraba a mayor temperatura que el agua de la piscina? Aunque, también les surgieron más dudas, ¿por qué en el caluroso balneario utilizaban ropa ligera y en su casa, ubicada en la Ciudad de México, tenían que usar suéter al salir por la noche? Para poder comprenderlo, decidieron investigar más acerca de los conceptos físicos involucrados como el calor y la temperatura.
¿Existe el frío?, ¿hace calor? Comenzaremos con la definición de temperatura.
Temperatura
A la temperatura la definimos como: “la energía cinética promedio de las moléculas de una sustancia”. Las escalas más utilizadas y que usamos para medirla son Fahrenheit, Celsius o centígrada y la escala Kelvin.
Haz clic en el siguiente enlace y abre el simulador. Aprecia que hay una cámara separada en dos secciones por una barrera; en cada sección hay un pulsador, incrementa en uno la temperatura y en el otro disminuye de tal manera que su diferencia sea grande, ¿qué sucede con el movimiento de las moléculas?

Observa que cada una de las moléculas tienen diferentes velocidades, aún cuando se encuentren en la misma cámara. Esto es importante para comprender que la temperatura es una magnitud que representa el promedio de la energía cinética de las moléculas.
Ahora, quita la barrera retirándola mediante el selector con flecha verde, ¿qué pasa con las moléculas?, ¿a qué sección pasan gran parte de las moléculas?
En la escala Celsius utilizamos la temperatura de congelación del agua como referencia para el valor cero (0 °C) y de ahí, todas las temperaturas más bajas se registran con valores negativos, pero ¿hay algún límite inferior?, es decir, que las moléculas estuvieran en reposo y el cuerpo no se pudiera enfriar más. De hecho, eso actualmente es imposible porque como pudiste apreciar las moléculas de una sustancia siempre están en movimiento, por lo que una sustancia siempre tendrá temperatura, pero nos permite definir el punto más bajo posible de temperatura.
Llamamos cero absoluto a la temperatura correspondiente a la menor energía cinética medida de las moléculas de un cuerpo. Esto corresponde a -273.15 °C o en la escala absoluta 0 K, cuya unidad de medida (kelvin) es la adoptada por el Sistema Internacional.
Por otro lado, la temperatura es una propiedad intensiva de la materia, esto quiere decir que no depende del tamaño de la muestra, es decir, no se suma la temperatura entre más masa se tenga de la muestra. Si tienes un recipiente con 1 L de agua a 23 °C y viertes en el mismo recipiente una taza con agua a 23 °C, ¿cuál será la temperatura final de la mezcla? En efecto, la temperatura final de la mezcla seguirá siendo de 23°C, no la suma de las temperaturas.
Abre el siguiente simulador y con base en las indicaciones, modifica los parámetros y ejecuta distintos escenarios.

Todos sabemos que los cuerpos pueden calentarse (aumentar su energía interna) o enfriarse (perder energía interna) tal como observaron Lupita y su hermano con el piso de concreto y el agua de la piscina en el balneario. La energía ganada o perdida en estos procesos es el calor. Pero aún faltaban algunas definiciones.
Calor
En termodinámica, sistema se denomina a la parte del universo que queremos estudiar. Así, un sistema puede ser un fluido confinado en un recipiente o por un campo gravitacional o electromagnético, una moneda, una pieza de metal, un planeta, una estrella, e incluso un ser vivo, etcétera.
La energía que se intercambia de manera espontánea entre dos o más sistemas debido a la diferencia de sus temperaturas, la denominamos calor. En otras palabras, entre dos cuerpos a diferente temperatura el calor siempre se transmite del más caliente al más frío hasta que se igualan las temperaturas, por lo que, un cuerpo puede ceder o ganar calor. En la naturaleza se busca siempre el equilibrio térmico y el calor es una “energía en tránsito”.
Al momento Lupita y su hermano ya tenían una noción de lo que es el calor y su diferencia con la temperatura, pero seguían preguntándose ¿cómo se calientan los cuerpos? Acaso, ¿el aumento de la temperatura es proporcional a la energía que le suministramos en forma de calor? Para ello realizaron la siguiente actividad.
Cálculo de la energía transferida: Ecuación de calor
Pedro quiso calentar una taza con agua para prepararse una infusión, para lo cual infirió que necesitaba una cantidad determinada de energía. Y pensó que si invitara a sus amigos, entonces por cada taza que prepare necesitará la misma cantidad de energía, así si prepara 4 tazas, necesitará 4 veces la energía que usó en una taza. Si prepara 6 tazas, entonces necesita 6 veces la misma energía. Por lo que pudo concluir que la energía requerida es directamente proporcional a la masa del sistema y anotó la siguiente expresión:
\[E\ {\color{Blue} \alpha} \ m\]
Lupita le dijo que también dependía de cuánto quiere calentar el agua, esto es, en cuántos grados quería cambiar la temperatura del sistema. Por ejemplo, si se considera que la taza con agua está a temperatura ambiente (por ejemplo, 20 °C), y se quiere elevar su temperatura hasta 40 °C, debe haber un cambio de temperatura de 20 °C y necesitaría cierta cantidad de energía, pero si se quiere calentar la taza con agua hasta 60 °C, se produce un cambio de temperatura de 40 °C, entonces necesitará el doble de energía que en el caso anterior. Por lo cual Lupita mencionó que la energía necesaria, es directamente proporcional al cambio de temperatura del sistema, por lo cual dedujo la expresión:
\[E\ {\color{Blue} \alpha} \ \Delta t\]
Anotaron las dos fórmulas en una sola relación de proporción y obtuvieron:
\[E\ {\color{Blue} \alpha} \ m\Delta t\]
Por último, investigaron que para establecer la fórmula le hacía falta una constante. Recordaron que si dejan una cuchara metálica en la taza caliente su temperatura sube rápidamente, lo cual no ocurriría si la cuchara fuese de madera, por lo cual, encontraron que depende del material y se le llama, calor específico. Aprendieron que dicha propiedad, tiene un valor para cada sustancia y aunque depende de la temperatura se considera constante, mientras no ocurra un cambio de fase.
Así la ecuación para cuantificar la energía transferida queda:
\[Q=mC_e\Delta t\]
Donde:
\[Q\] es la energía transferida debido a la diferencia de temperatura, esto es, calor.
\[m\] es la masa del sistema.
\[C_e\] se denomina calor específico, cuyo valor es diferente para cada material.
De aquí se define que una caloría (1 cal) equivale a la cantidad de energía que se necesita suministrarle a 1 g de agua para que aumente 1 ºC su temperatura.
En camino al balneario, hicieron una parada para comer quesadillas. Recordaron que su profesor de física les había comentado que algunos alimentos permanecen calientes mucho más tiempo que otros, por lo que para poder comer una quesadilla recién hecha, tuvieron que abrirla para que el queso se enfriara, ya que estaba mucho más caliente que la tortilla. Entonces, pudieron concluir que no todas las sustancias aumentan su temperatura de manera igual al recibir el calor y, por lo tanto, la mayor o menor dificultad de una sustancia para calentarse o enfriarse es el calor específico.
Además, Lupita y Pedro concluyeron que el concreto del balneario no estaba a mayor temperatura o cedía más calor, sino que sus pies recibían más energía cuando pisaban el concreto que cuando estaban en el agua de la piscina.
Hasta ahora hemos comentado que la caloría se utiliza como unidad de medida para el calor, pero ¿habrá alguna correspondencia entre la energía mecánica? James Prescott Joule (1818 – 1889) diseñó un dispositivo para medir ese valor, lo cual permitió obtener los cálculos necesarios para las máquinas que se iban desarrollando en plena era industrial. Vamos a revisarlo a continuación.
Equivalente mecánico del calor
Existen diversas formas para incrementar la temperatura de un sistema, una manera es suministrarle energía térmica, otra manera es a través de un proceso mecánico De hecho, Joule, estableció el llamado equivalente mecánico del calor. Aumentó la temperatura de un sistema a través de trabajo mecánico, una manera muy conocida por todos, es mediante fricción. Si frotamos ambas manos y la temperatura se incrementa, si intentamos cortar un metal con una segueta sin filo, seguramente el metal no se cortará, pero aumentará su temperatura.
Para que veas una representación del experimento de Joule, da clic en el siguiente enlace. Con los botones ubicados en la parte inferior derecha de la pantalla, inicia, pausa o reinicia el movimiento. Ejecútalo varias veces para que las pesas caigan por la acción de la gravedad, haciendo girar la rueda de palas sumergida en agua y observa el cambio de temperatura en el termómetro.
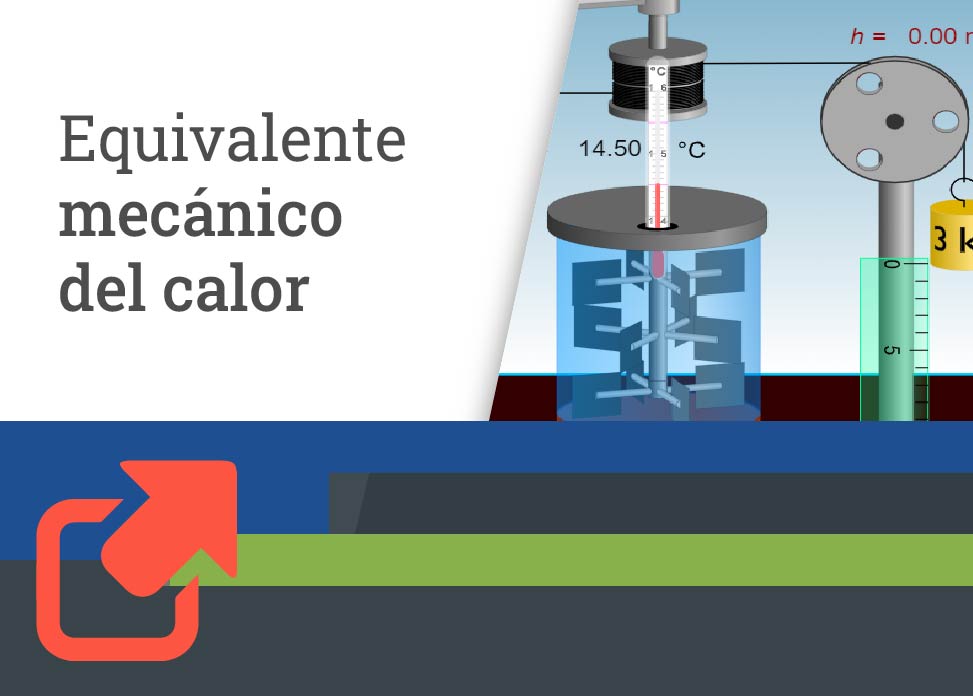
Al caer las pesas, su energía potencial va disminuyendo transmitiendo al agua mediante el movimiento de las palas. Debido a la resistencia del agua se acumula como energía térmica, lo que provoca un aumento de la temperatura. Con ello, Joule determinó que una cantidad dada de trabajo mecánico realizado siempre era equivalente a una cantidad particular de entrada de calor. En términos cuantitativos encontró que: 4.186 joules (J) de trabajo eran equivalentes a 1 caloría (cal). Esto se conoce como el equivalente mecánico del calor y se puede afirmar que la energía mecánica siempre se puede convertir en calor, es decir,
Cambio de energía mecánica = Cambio de energía interna
\[\Delta E_P=\Delta U\]
Actividad H5P
¡Es el momento de revisar lo aprendido! Realiza la siguiente actividad.