Como ya vimos en el ciclo hidrológico podemos encontrar al agua en tres estados de agregación en la naturaleza. Tanto esta sustancia como la materia que nos rodea, tiene masa, ocupa un lugar en el espacio y puede encontrarse en diferentes estados de agregación. Debido a las condiciones que existen en la superficie terrestre, la materia se encuentra en estado sólido, líquido, gaseoso, plasma y condensado de Bose- Einstein.
Observa el siguiente video y toma notas sobre las características de cada estado.
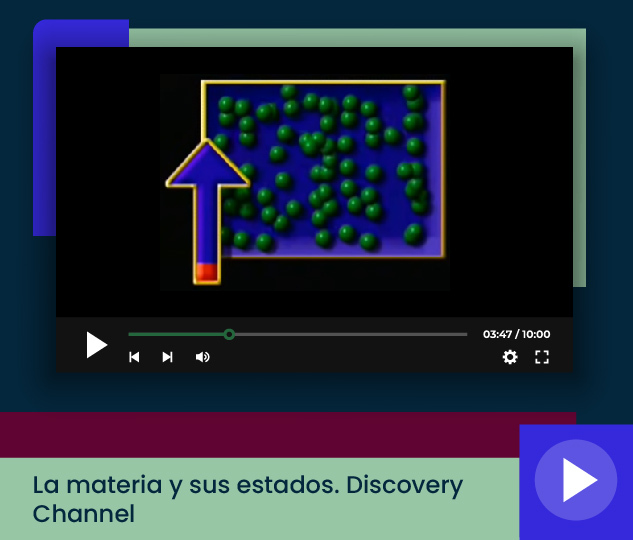
Cambios de estado de la materia
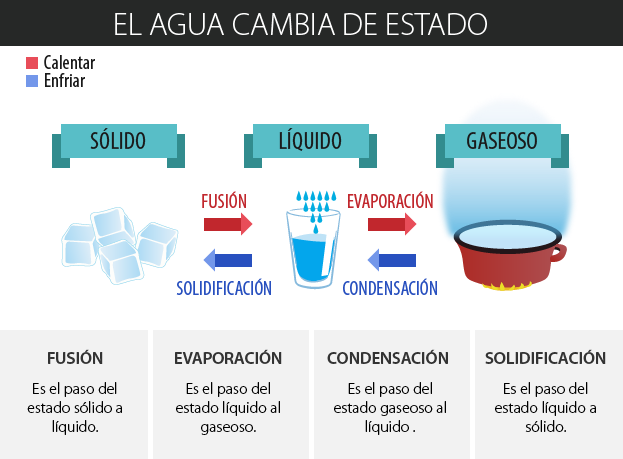
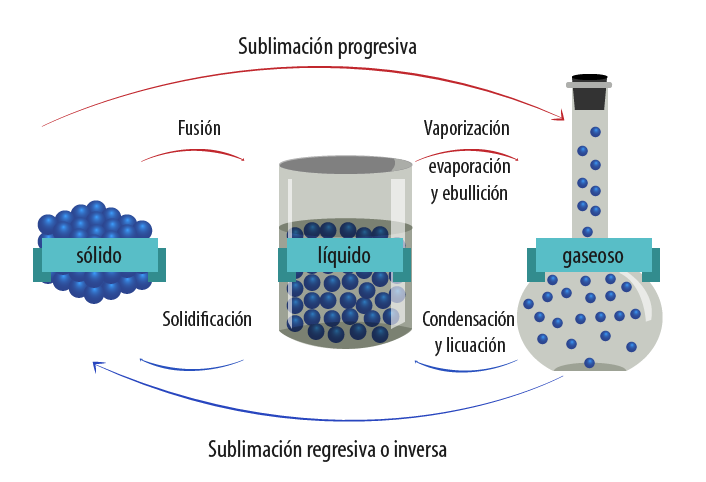
Cuando una sustancia se encuentra en cualquiera de los estados de agregación que acabamos de revisar, y se somete a una variación de temperatura o presión, se dice que cambia de estado. En la siguiente imagen puedes conocer los nombres de los diferentes procesos físicos cuando el agua cambia de estado; por ejemplo, si se encuentra en estado sólido (hielo) y pasa al estado líquido o, bien, si el agua en estado líquido se calienta, ebulle (comúnmente se dice que hierve) y se convierte en vapor de agua.
En general, cualquier sustancia es sólida a baja temperatura y gaseosa a alta temperatura. Si tomas un cubo de hielo del congelador de tu refrigerador y lo colocas en un vaso, podrás ver que comienza a derretirse (fundirse) poco a poco hasta convertirse en agua en estado líquido. Esto ocurre porque el cubo de hielo se encuentra en estado sólido a una temperatura de 0 °C y, al momento de depositarlo en el vaso, éste se encuentra a temperatura ambiente, aproximadamente a 21 °C, dependiendo del lugar donde te encuentres. Lo importante es que el hielo y el vaso se encuentran a diferente temperatura, de tal forma que el vaso le suministra energía en forma de calor al hielo, provocando que las partículas del sólido comiencen a moverse más rápidamente y venzan las fuerzas de cohesión, transformándose de hielo a agua líquida. Mientras ocurre el paso de estado sólido a líquido, la temperatura permanece constante (0 °C) en el cubo de hielo, hasta que éste cambia a estado líquido. A este proceso se le conoce como fusión.
En el siguiente video observa a nivel microscópico el proceso de de un cubo de hielo.
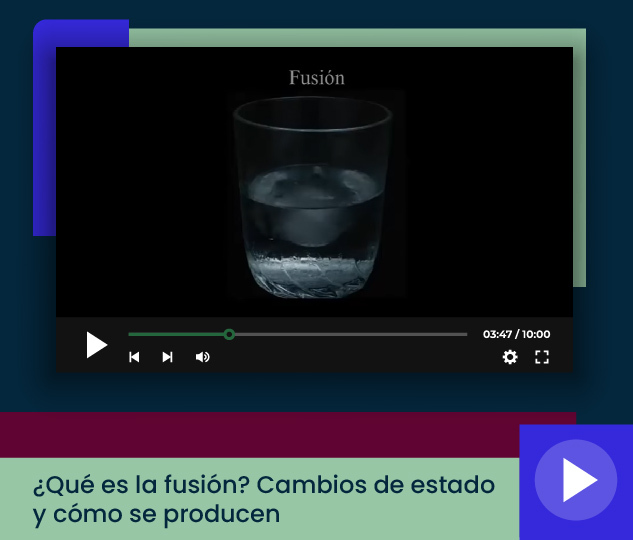
La temperatura a la que un sólido se funde se conoce como punto o temperatura de fusión, la cual es una propiedad de cada sustancia que permite distinguirla de las demás. Así, el punto o temperatura de fusión del agua a nivel del mar es de 0 °C.
El proceso contrario a la fusión se conoce como solidificación. Seguramente lo has observado cuando introduces una charola de cubos de hielo con agua al congelador. El agua se encuentra a temperatura ambiente, por lo que, al comenzar a ceder energía en forma de calor al congelador, que se encuentra aproximadamente a -11 °C, las partículas del líquido dejan de moverse libremente y comienzan a predominar las fuerzas de cohesión, hasta que a 0 °C, el agua se solidifica.
| Condensación El cambio de estado gaseoso a estado líquido se conoce como condensación. Si al recipiente que contiene agua hirviendo le colocas una tapa por un minuto y después la retiras, podrás observar que se forman pequeñas gotas de agua en el interior de la misma, ya que, inicialmente, la tapa se encuentra a temperatura ambiente, pero al momento de colocarla sobre el recipiente, el vapor que se desprende a 100 °C choca con ella y al ceder energía en forma de calor, las partículas del vapor disminuyen su movimiento y comienzan a aparecer las fuerzas de cohesión, lo que provoca el cambio de gas a líquido. Como dijimos, este proceso se llama condensación. 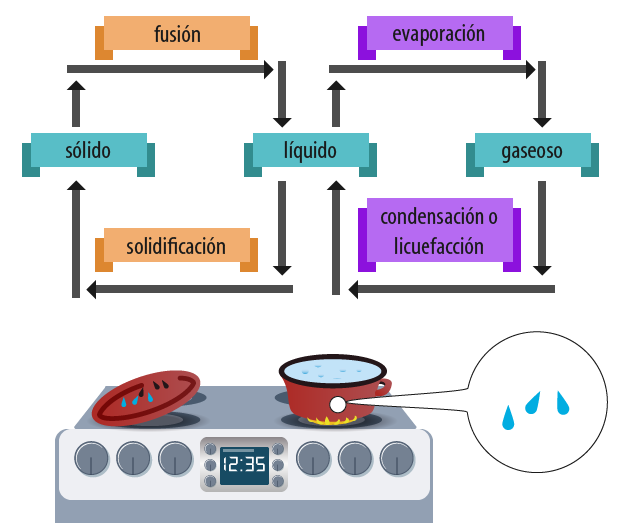 Imagen de B@UNAM Cuando pones a calentar agua en un recipiente, sabes que está a punto de hervir (ebullir) porque, sin necesidad de acercarte, puedes observar que sobre él se ha formado vapor de agua. A este proceso se le conoce como evaporación. Este cambio sólo se presenta en la superficie de un líquido, ya que al transferirle energía en forma de calor, comienzan a predominar las fuerzas de repulsión, lo que provoca que sus partículas se muevan libremente. Entonces, las corrientes de aire contribuyen a que las partículas de la superficie se desprendan y cambien de estado líquido a gaseoso. Por eso, cuando lavamos la ropa y hay viento, se seca rápido. Lo mismo ocurre con los charcos: se secan al recibir los rayos del sol, hasta que toda el agua pasa de líquido a vapor. Después de que en la superficie hay evaporación, si en el resto del líquido se sigue transfiriendo energía en forma de calor, se forman burbujas de vapor en todo el líquido que se elevan a la superficie por diferencia de densidades. A este proceso se le conoce como ebullición. La temperatura a la que un líquido se transforma en gas se conoce como punto o temperatura de ebullición, y ocurre debido a que la presión de vapor iguala a la presión atmosférica. Como la presión atmosférica cambia con las condiciones meteorológicas y con la altitud, los puntos o temperaturas de ebullición son variables. El punto o temperatura de ebullición del agua a nivel del mar es de 100 °C, en Madrid es de 98 °C y en la Ciudad de México es de 92 °C; sin embargo, ninguna otra sustancia presenta estos valores bajo las mismas condiciones, por lo que podemos distinguir una sustancia de otra por su punto o temperatura de ebullición. Licuefacción La licuefacción es el proceso que se lleva a cabo cuando una sustancia en condiciones ambientales se encuentra en estado gaseoso, y cambia a estado líquido por efecto de la temperatura y la presión. Si se disminuye la temperatura y se ejerce presión sobre un gas que se encuentra a temperatura ambiente, cambia de gas a líquido. Seguramente has visto alguna vez tanques de oxígeno para enfermos con un rótulo que dice “oxígeno líquido” o, bien, pipas que transportan gas butano LP ¿Sabías que LP significa “licuado a presión”? Sublimación Después de una nevada, se ve una especie de niebla o vapor sobre la nieve. Esto se debe a que está ocurriendo la sublimación, que es el cambio de estado sólido a estado gaseoso sin pasar por el estado líquido. No todas las sustancias pueden sublimarse. Seguramente has visto el hielo seco, tan usado en las fiestas o antros, el cual no es más que dióxido de carbono sublimándose. También has comprado algún aromatizante para tu casa y, al momento de abrirlo, inmediatamente percibes el olor característico a vainilla o lavanda. Lo que ocurre es una sublimación: al momento de romper el seguro de la pastilla, pasa de sólido a gas de manera directa. Deposición o cristalización El proceso inverso a la sublimación es conocido como cristalización, deposición o sublimación regresiva, es decir, el paso del estado gaseoso al estado sólido sin pasar por el líquido; es un método muy utilizado para purificar sustancias. |
No debes olvidar que una sustancia, a pesar de cambiar de estado, sigue siendo la misma. Por ejemplo, el agua que en estado sólido es llamada hielo; sin embargo, sigue siendo agua, y cuando se evapora, la conocemos como vapor de agua. No se transforma en otra sustancia diferente.
Para conocer más sobre los cambios de estado de la materia, a nivel nanoscópico, observa el siguiente video.

Ahora, no sólo ya conoces los estados de agregación, también puedes identificar los diferentes cambios que ocurren entre ellos por efecto de la presión o la temperatura, como:
- Fusión
- Solidificación
- Evaporación
- Ebullición
- Condensación
- Licuefacción
- Sublimación
- Cristalización